研究方向
微生物组在不同尺度上都是复杂的,从单细胞之间的随机性到数百个相互作用的物种之间的无序性。传统的低通量相关性研究无法有效地理解这种复杂性,我们通过整合理论和高通量实验来克服这一挑战。主要的理论方法包括生态动力学的数学模型和这些模型的统计物理学分析。实验方法包括肠道微生物群的体外组装以及使用元基因组学和代谢组学对其进行分析。这种理论和实验的结合将促进落实微生物组的定量改造。正在进行的研究项目包括:
量化微生物相互作用
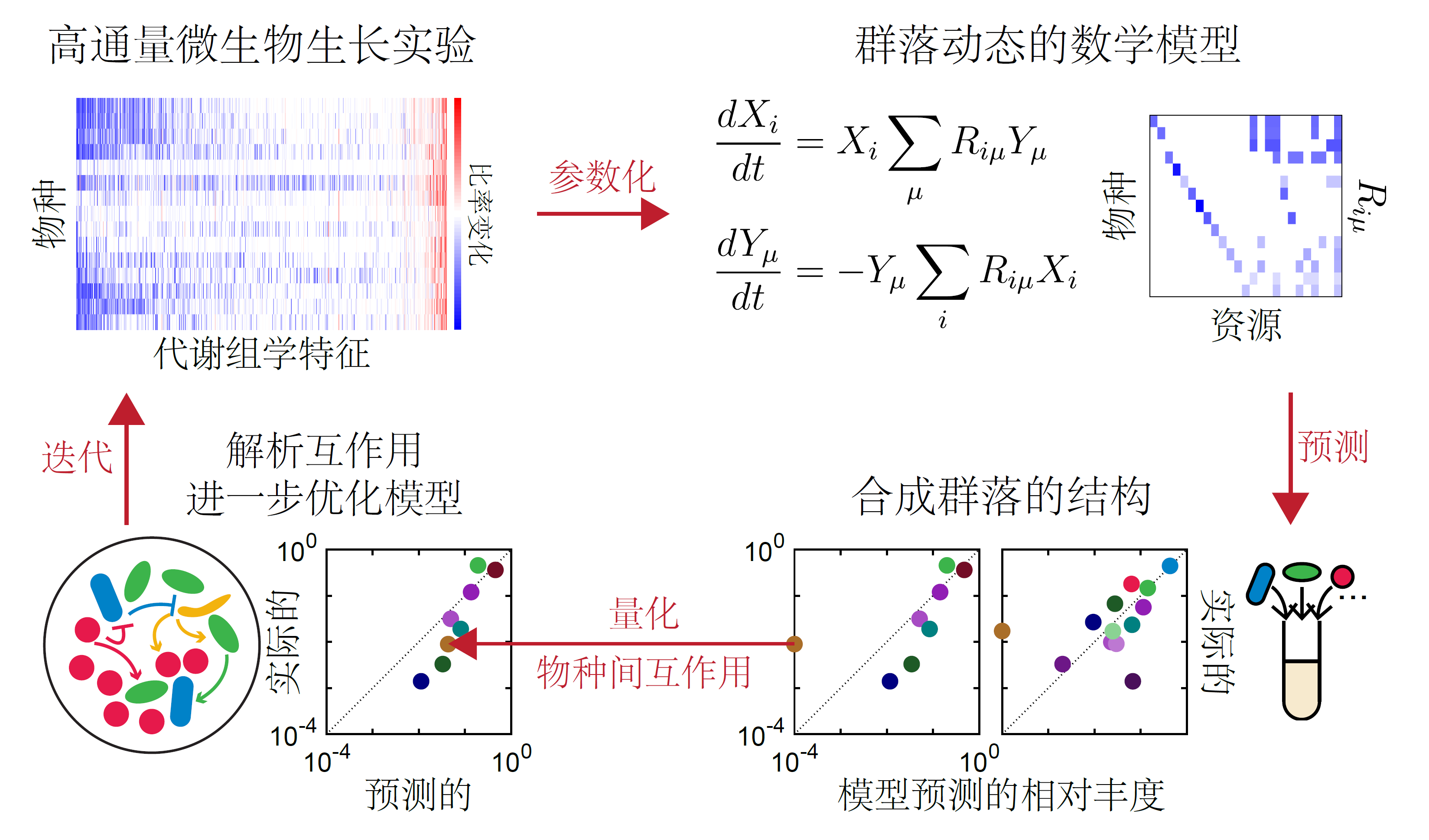
微生物通过许多机制进行互动,包括资源竞争、代谢交叉和环境调控。我们利用群落组装实验、代谢组学、基因组学和数学模型把个别的机制解开。
- 我们能够通过单个肠道菌种的代谢组学来预测体外的群落动态(Ho et al, Nat Microbiol 2024)。我们正在运用类似方法来研究复杂环境中和进化过程中的微生物相互作用。
- 抗生素作用可以影响物种间的资源竞争,反之亦然,这种相互作用可以导致多种抗生素之间的协同或抑制作用(Newton et al. Nat Commun 2023)。我们正在使用高通量筛选实验测试这些模型预测,并利用它们来设计群落动态。
微生物组定量工程的高通量实验和机制性数学模型
为了量化地设计微生物群的组成和功能,我们建立理论和实验工具来剖析复杂的群落,重点关注于人类肠道菌群。
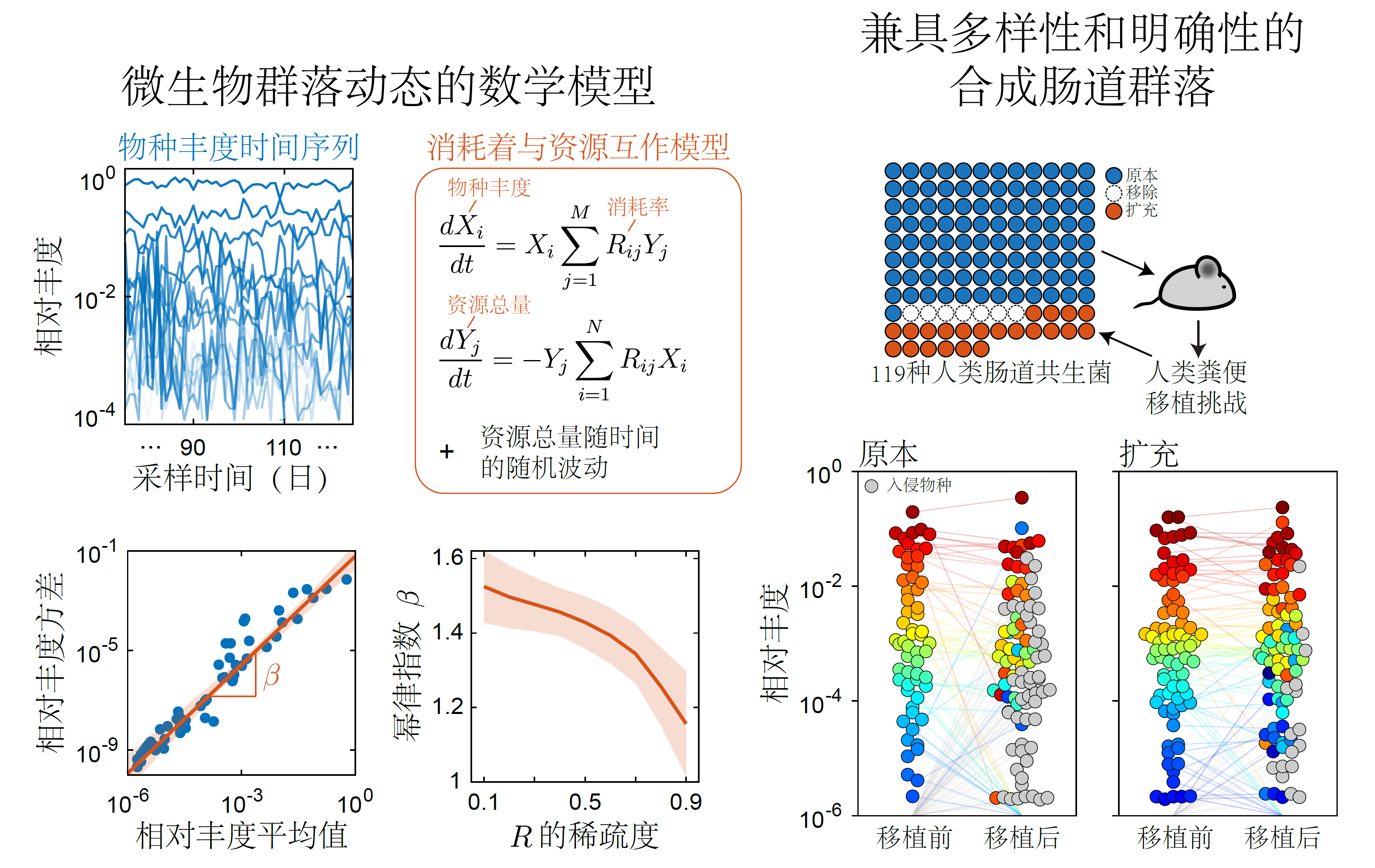
- 广泛微生物群的物种丰度表现出特殊的时间波动,这些波动可以通过资源竞争的数学模型来重现(Ho et al, eLife 2022)。我们正在利用这关系来推断各种微生物群的动态启动因素。
- 我们构建了一个兼具高度多样性和明确性的模式群落,此群落可重复性地定植于小鼠肠道,而且被模式群落或人类粪便群落定植的小鼠在表型上是相似的(Cheng et al, Cell 2022)。我们正在系统性地量化此模式系统中各物种的相互作用。
微生物细胞周期调控的定量原理

微生物细胞协调其生长和细胞周期以维持稳定的大小,但细胞如何感知其大小、决定分裂时间和协调细胞周期事件仍不清楚。我们使用微流控成像来捕捉单细胞如何在随机性的影响下生长和分裂,并通过构建基因网络的数学模型来分析这些数据,了解微生物细胞周期调控的设计原理。
- 我们发现一个简单的定量规律准确描述了来自生命三个域里的微生物运用的细胞大小调控方法(Ho et al, Annu Rev Biophys 2018)。这一普遍性如何、以及为何出现仍然是未决的问题。
- 蓝藻也遵循上面描述的普遍规律,除了生物钟导致的一简易修改(Ho et al, Biophys J 2020)。这种耦合如何影响蓝藻种群的成长速度和适应度?